Oxidação: Chama e sua estrutura, Combate aos incêndios, Combustíveis
Oxidação
A oxidação, também chamada reacção de oxidação, é a reacção
química que ocorre entre o oxigénio e qualquer outra substância ou é o processo
acompanhado pelo ganho de oxigénio.
Por
exemplo, as reacções abaixo são reacções de oxidação pois, tanto o enxofre, o
cálcio como o ferro, ganham o oxigénio formando produtos chamados óxidos.
S(s) + O2 (g) → SO2
(s)
2Ca(s) + O2 (g) → 2CaO (s)
4Fe(s) + 3O2
(g) → 2Fe2O3 (s)
A oxidação é
uma reacção que ocorre com muita frequência no nosso dia-a-dia, sendo responsável
pelo processo
de respiração, pelos incêndios e
pela corrosão
dos metais.
Para evitar a corrosão dos metais, é
válida toda a acção ou medida que tende a evitar o contacto entre o metal e os outros
reagentes como, por exemplo, a água e os gases do ar.
Para tal, adopta-se a pintura de objectos por revestimento plástico, por uma
camada de outro metal menos corrosivo, por um óxido, por uma liga, por um
verniz ou por uma gordura. A galvanoplastia permite
dourar, pratear, niquelar, bronzear, estanhar objectos metálicos, evitando
assim a sua oxidação.
Uma característica comum à maior parte
das reacções de oxidação é a libertação de energia (em forma de calor, luz,
chama ou som), As reacções de oxidação acompanhadas de libertação de energia
designam reacções
de combustão ou, apenas, combustão.
As combustões são reacções que ocorrem entre o combustível,
substância que arde, e o comburente, substância que faz arder o
combustível, geralmente, o oxigénio.
Para que ocorra uma combustão é
necessário aquecer a substância até sua temperatura de inflamação (a temperatura
a partir da qual a substância pode começar a arder) e garantir que a substância
esteja em contacto permanente com o oxigénio.
Existem dois tipos de combustão: combustão lenta
e combustão
viva. Na combustão lenta, a reacção do oxigénio com o
combustível é acompanhada por libertação de energia
sob a forma de calor e sem luz,
por exemplo, o aparecimento da ferrugem é resultado da ocorrência da reacção do
ferro com o oxigénio do ar, processo que é acompanhado por libertação de
pequenas quantidades de calor, assim como, o processo de assimilação dos alimentos
no organismo humano, em que o oxigénio reage com os alimentos, formando dióxido
de carbono e água, liberta pequenas quantidades de energia sob a forma de
calor.
A combustão viva é
a reacção do oxigénio com uma substância combustível e é acompanhada pela
libertação de energia sob a forma de calor e luz (chama ou incandescência).
Por
exemplo, as combustões do sódio, magnésio, enxofre e carbono, além de calor,
também, libertam chamas de colorações diferentes.
4Na(s) + O2 (g) → 2Na2O(s)
2Mg(s) + O2 (g) → 2MgO(s)
S(s) + O2 (g) → SO2
(s)
C(s) + O2
(g) → CO2 (s)
Quando se acciona dinamite em minas, a
combustão que ocorre diz-se explosiva, liberta grande quantidade de calor,
luz e som, dando-se a explosão.
As combustões são reacções químicas
muito importantes, pois delas muito depende o progresso da humanidade. Por
exemplo, combustão do acetileno realiza-se o corte e a soldadura dos metais.
Pela combustão do butano confecionam-se alimentos usando fogões a gás.
A combustão do carvão permite
confecionar os alimentos, fundir os metais, o funcionamento das centrais
térmicas que produzem a energia eléctrica e o andamento de locomotivas. A combustão
da gasolina e do gasóleo permite o funcionamento de motores de automóveis,
aviões e motobombas para irrigação.
Chama e sua estrutura
A característica da combustão viva é,
para além da libertação de calor, a libertação de energia luminosa. A parte
ardente e luminosa libertada pelas substâncias em combustão viva designa-se chama.
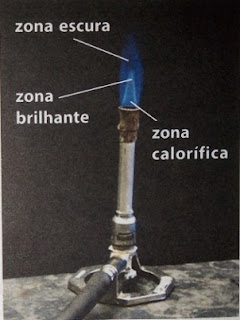 |
| Fig. 41 - A chama apresenta três zonas. |
A chama é constituída por três partes
distintas:
- A zona escura, que é a parte mais interna da chama.
- A zona brilhante, que se encontra mais para o centro da chama e que confere brilho à chama.
- A zona calorifica, que é a parte externa e quase que invisível.
É esta última que apresenta
temperaturas elevadas e que serve para o aquecimento.
Combate aos incêndios
O combate aos incêndios consiste no
uso de procedimentos que contrariem as condições que favorecem a ocorrência de
uma combustão viva. Para tal, procura-se arrefecer a
substância em ardor e evitar ou diminuir o contacto do
oxigénio com a substância ardente.
É, por isso, que para apagar o carvão
em brasa, muitas vezes, opta-se por cobrir todo o carvão com areia, para apagar
o capim em chama bate-se a chama com ramos de árvores para abafá-la ou deita-se
água e em caso de ardor da roupa ou cama, cobre-se a chama com uma toalha ou
cobertor molhado.
A indústria química produz substâncias
que dadas as suas propriedades são usadas para a extinção de incêndios. O dióxido de
carbono, por não alimentar as combustões, é muito usado em
extintores de incêndio. Existem outras substâncias, como o tetracloreto de carbono, que são
usadas para o efeito.
Combustíveis
Na linguagem comum, o combustível é a substância, isto é, arde em presença do
oxigénio do ar. Contudo, genericamente, é a substância que é oxidada numa
reacção de combustão.
De acordo com a capacidade de reposição, os
combustíveis são classificados em:
- Recursos não renováveis
- Recursos renováveis
Os combustíveis não renováveis são os combustíveis cuja capacidade de renovação
ou de reposição é muito baixa em relação ao nível de consumo.
Fazem parte deste grupo, os
combustíveis fósseis, cuja capacidade de reposição leva milhões de anos como,
por exemplo, o petróleo, o gás natural e o carvão. De acordo com as quantidades
disponíveis nas reservas, estima-se que a capacidade da Terra fornecer estes
combustíveis é de pouco mais do que 40 anos.
Os combustíveis fósseis são
responsáveis pela poluição do meio ambiente visto que durante a sua combustão
são libertados gases como o dióxido de carbono que é responsável pelo efeito de
estufa, o monóxido de carbono que interfere no processo
respiratório, além de produtos secundários como os óxidos de enxofre e de nitrogénio,
responsáveis pelas chuvas ácidas.
Também contribui negativamente para o
meio ambiente a produto deste tipo de combustível na medida em que a produção
do carvão vegetal, por exemplo, requer o abate ou desflorestamento, diminuindo
as árvores que teriam uma contribuição significativa na redução do teor de
dióxido de carbono com a realização da fotossíntese.
Os combustíveis renováveis são aqueles que provém de fontes naturais que são
renováveis naturalmente.
Fazem parte deste grupo, a energia
solar (proveniente do Sol); a energia eólica (proveniente
do vento); a energia
hidráulica (proveniente da
corrente dos rios e água doce); a energia maremotriz
(proveniente dos mares e oceanos); a energia das ondas (proveniente das ondas); a biomassa ou biocombustível (proveniente da matéria orgânica); a energia azul (proveniente da água salobra); a energia
geotérmica (proveniente do calor da Terra).
Os combustíveis renováveis têm menor
impacto ambiental.
Bibliografia
AFONSO, Amadeu; DOMINGOS, Ernesto. Q8 – Química 8ª Classe. 2ª Edição. Texto Editores, Maputo, 2020.


Comentários