Estrutura de Lewis e Regra do Octeto
Estrutura de Lewis e Regra do Octeto
O químico Gilbert Lewis propôs uma representação esquemática para os átomos e moléculas, evidenciando a partilha de electrões, que ficou conhecida como notação ou representação de Lewis.
Na notação de Lewis, os átomos de cada elemento são representados pelo respectivo símbolo químico e os electrões de valência por pontos (●) ou cruzes (x).
Numa molécula, os pares de electrões partilhados representam-se por pares de pontos ou cruzes ou ainda por traços entre os símbolos dos átomos, evidenciando a ligação. A representação por ● ou x serve para diferenciar os electrões de um e de outro átomo, ainda que não se distinga na molécula a que átomo pertence cada um dos electrões.
Feita a distribuição electrónica, os electrões de valência, na notação de Lewis, são representados mediante a colocação de pontos ou cruzes em redor do símbolo do elemento químico.
Geralmente procura-se agrupar os electrões aos pares (dois a dois). Na formação das moléculas os electrões de um átomo são emparelhados com os do outro constituindo pares electrónicos de ligação.
Exemplos:
Bibliografia
SILVA, Filomena Neves. Q9 – Química 9ª Classe. 2ª Edição. Texto Editores, Maputo, 2017.


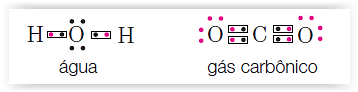



Comentários